勒夏特列原理内容有哪些?
在一个已经达到平衡的反应中,如果改变影响平衡的条件之一(如温度、压强,以及参加反应的化学物质的浓度),平衡将向着能够减弱这种改变的方向移动。
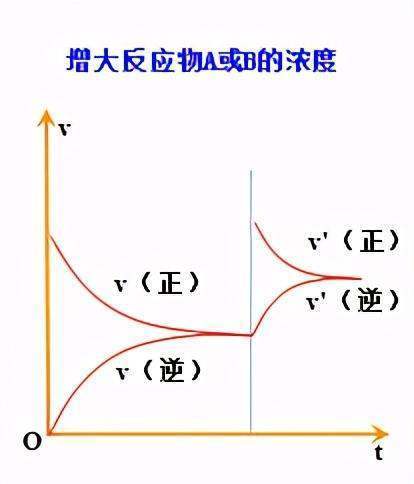
比如一个可逆反应中,当增加反应物的浓度时,平衡要向正反应方向移动,平衡的移动使得增加的反应物浓度又会逐步减少;但这种减弱不可能消除增加反应物浓度对这种反应物本身的影响,与旧的平衡体系中这种反应物的浓度相比而言,还是增加了。
在有气体参加或生成的可逆反应中,当增加压强时,平衡总是向压强减小的方向移动,比如在N2+3H2 ⇌2NH3这个可逆反应中,达到一个平衡后,对这个体系进行加压比如压强增加为原来的两倍,这时旧的平衡要被打破,平衡向压强减小的方向移动,即在本反应中向正反应方向移动;
建立新的平衡时,增加的压强即被减弱,不再是原平衡的两倍,但这种增加的压强不可能完全被消除,也不是与原平衡相同,而是处于这两者之间。
应用
在经济学中,类似的概念也以Le Chatelier命名,于1947年由美国经济学家Paul Samuelson提出。在那里,广义的Le Chatelier原理是为了实现经济平衡的最大条件:其中函数的所有未知数都是独立变量,具有辅助约束-”保持初始平衡不变”,减少了对参数变化的响应。
因此,由于短期内的固定成本约束,假设短期内的要素需求弹性和商品供应弹性要低于长期的弹性。
由于包络定理描述了最大位置附近目标函数值的变化,因此勒查特利尔原理可以证明是其推论。
Le Chatelier的原理扎根于化学平衡并扩展到经济学理论,但它也可以用于描述机械系统,因为处于压力之下的系统将以减小或最小化该压力的方式做出响应。
而且,响应通常是通过最容易缓解压力的机制进行的。剪切销和其他此类牺牲装置是设计要素,可保护系统免受不希望的方式施加的应力,以减轻应力,从而防止对整个系统造成更大的损害,这是勒查特利尔原理的实际工程应用。
以上内容参考 百度百科-勒夏特列原理